Rumusrumus.com – kali ini akan membahas perihal atom yang mencakup pengertian, jenis, grafik, tabel, kecenderungan, dan cara mencari jari – jari atom beserta akan dibahas beberapa nilai jari-jari atom tersebut.
Pengertian
Jari-jari atom yaitu jarak dari inti atom ke orbital elektron yang paling luar yang stabil pada suatu atom dalam keadaan setimbang. Biasanya jarak itu diukur kedalam satuan pikometer atau angstrom. hal itu karna elektron-elektron senantiasa bergerak, maka untuk mengukur jarak dari inti atom kepadanya begitu sulit. Untuk itu dipakai beberapa cara yang lebih akurat
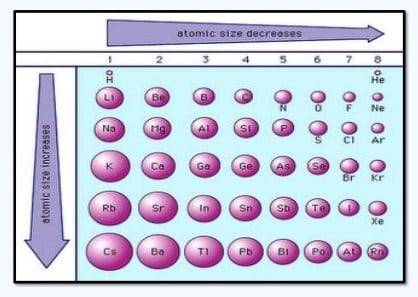
Kecenderungan Jari-Jari Atom
Jenis
Terdapat beberapa jenis jari-jari atom yang dipaka untuk menyatakan jarak dari inti atom ke lintasan stabil yang paling luar dari elektronnya, di antaranya yaitu :
- Jari-jari kovalen
- Jari-jari logam
- Jari-jari van der Waals
Ketiganya dipilih disebabkan oleh perbedaan dari sifat-sifat elemen yang diukur.
1. Jari-jari Kovalen
Jari-jari atom diukur menggunakan jari-jari kovalen untuk elemen-elemen yang memiliki jenis ikatan kovalen. Pada umumnya elemen-elemen ini merupakan elemen-elemen non-logam. Secara teknis jarak yang diukur yaitu setengah dari jarak internuklir antara dua atom bertetangga terdekat dalam kisi kristal.
Jari-jari kovalen untuk elemen-elemen yang tidak sanggup berikatan sanggup diperkirakan dengan cara melaksanakan kombinasi jari-jari dari elemen-elemen yang sanggup berikatan pada molekul untuk atom yang berbeda atau tak sama.
2. Jari-jari Logam
Jari-jari atom diukur menggunakan jari-jari logam untuk elemen-elemen yang termasuk pada elemen-elemen logam. Jari-jari logam yaitu setengah jarak dari jarak internuklir terdekat dari atom-atom dalam kristal logam.
3. Jari-jari Van Der Waals
Jari-jari atom diukur menggunakan jari-jari van der Waals untuk elemen yang atom-atomnya tak sanggup saling berikatan. Contoh dari kelompok ini yaitu gas mulia, di mana dikatakan bahwa atom-atom dari elemen ini tidak termampatkan atau terpadatkan.
Dalam tabel periodik, jari-jari atom bertambah nilainya palu satu golongan ke bawah sejalan dengan bertambahnya lintasan elektron, dan berkurang kiri ke kanan lantaran dengan bertambahnya muatan inti – dengan perkecualian untuk golongan gas mulia.
Tabel Nilai Jari Jari Atom
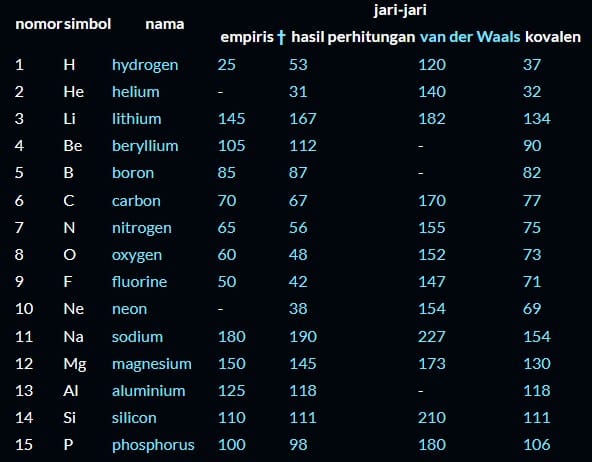
Keterangan:
Semua pengukuran ditulis dalam satuan pikometer (pm).
Faktor Yang Mempengaruhi Panjang Jari-Jari Atom
1. Jumlah kulit atom
Semakin banyak jumlah kulit yang dimiliki pada suatu atom, maka jari-jari atomnya juga semakin panjang. Nilai senyama atom Natrium lebih panjang daripada Litium, dikarenakan jumlah kulit yang dimiliki atom Natrium itu lebih banyak daripada atom Litium itu sendiri.
2. Muatan inti atom
Apabila jumlah kulit dari dua atom ialah sama banyak, maka yang kuat pada panjangnya yaitu muatan inti atom. Makin banyak inti atom berarti makin besar juga muatan pada dasarnya dan gaya tarik inti atom pada elektron lebih kuat sampai elektron lebih mendekat ke inti atom.
Dalam tabel periodik sanggup diamati bahwa:
- Didalam satu periode dari kiri kekanan semakin pendek, sedangkan unsur satu golongan dari atas kebawah semakin panjang. Hal ini sanggup dijelaskan sebenarnya kecenderungan tersebut di akibatkan karna adanya gaya tarik inti terhadap suatu elekltron dan jumlah kulit elektron.
- Pada satu periode dari kiri ke kanan muatan inti semakin bertambah, sedangkan jumlah kulit elektronnya tetap, alhasil yaitu gaya tarik inti pada elektron terluar makin kuat sampai menngakibatkan jarak elektron kulit terluar dengan inti makin dekat.
- Dalam satu golongan semakin kebawah jumlah kulit semakin banyak walaupun dalam hal ini jumlah muatan inti semakin banyak, Akan tetapi efek bertambahnya jumlah kulit itu lebih besar daripada efek muatan inti, menyebabkan jarak elektron kulit terluar terhadap inti semakin jauh
Artikel Terkait :
Sumber https://rumusrumus.com