Rumusrumus.com kali ini akan membahas wacana Afinitas elektron beserta tabel periodik, Ionisasi, Keelektronegatifan serta sifat afinitas elektron, grafik energi ionisasi, pola ionisasi energi serta pola ionisasi, lebih lengkapnya simak uraian dibawah ini
Pengertian Afinitas Elektron
Afinitas Elektron adalah negatif dari perubahan energi yang terjadi ketika satu elektron diterima oleh atom suatu unsur dalam keadaan gas.
Dalam hal lain dinyatakan juga dalam kJ mol–1. Unsur yang mempunyai afinitas elektron bertanda negatif, berarti mempunyai kecenderungan lebih besar dalam menyerap elektron daripada unsur yang afinitas elektronnya bertanda positif. Semakin negatif nilai afinitas elektron, maka makin besar kecenderungan unsur tersebut dalam menyerap elektron (kecenderungan membentuk ion negatif.
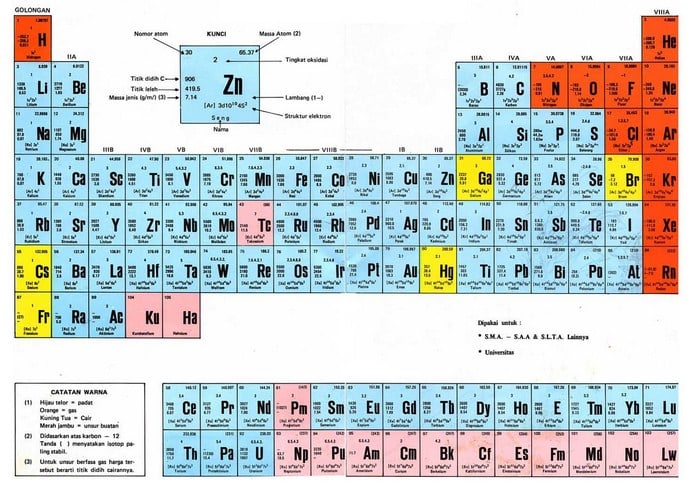
Tabel Periodik
Sifat Afinitas Elektron dalam Sistem Keperiodikan Unsur
- Pada satu periode, afinitas elektron cenderung bertambah dari kiri ke kanan.
- Pada satu golongan, afinitas elektron cenderung berkurang dari atas hingga bawah
- Terkecuali unsur alkali pada tanah dan gas mulia, semua unsur golongan utama mempunyai afinitas elektron bertanda negatif. Afinitas elektron terbesar dimiliki golongan halogen.
Afinitas Elektron Terbesar
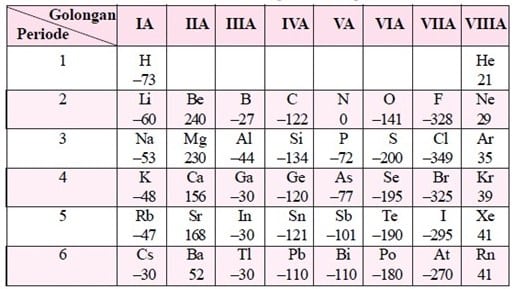
Semua unsur golongan utama mempunyai afinitas elektron bertanda negatif. Terkecuali unsur alkali tanah (IIA) dan gas mulia (VIIIA). Afinitas elektron terbesar dimiliki unsur halogen (VIIA) sebab unsur golongan ini yang paling gampang menangkap elektron. Maka, unsur yang mempunyai afinitas elektron terbesar yakni Klor dengan nilai afinitas –349,0
Afinitas Elektron Terkecil
Afinitas elektron yang terkecil yakni Fransium berdasarkan kecenderungan tabel periodik. Tetapi pada faktanya yang terkecil yaitu berilium dengan nilai afinitas +240,0.
Keelektronegatifan
Keelektronegatifan yaitu skala yang sanggup menjelaskan kecenderungan atom pada suatu unsur guna menarik elektron menuju kepadanya dalam suatu ikatan.
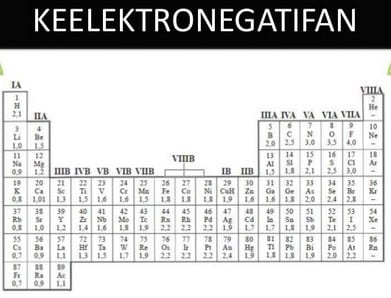
Keelektronegatifan secara umum, dalam satu periode, dari kiri ke kanan semakin bertambah dan dalam satu golongan, Fenomena ini menyebabkan jari-jari atom makin kecil, energi ionisasi makin besar, afinitas elektron makin besar dan makin negatif dan kesudahannya kecenderungan untuk menarik elektron makin besar.
Elektronegatifitas
Keelektronegatifan skala Pauling
Bahwa untuk unsur gas mulia tidak mempunyai harga keelektronegatifan sebab konfigurasi elektronnya yang stabil. Stabilitas gas mulia menyebabkan gas mulia sulit untuk menarik maupun melepas elektron. Keelektronegatifan skala pauling memperlihatkan nilai keelektronegatifan untuk gas mulia sebesar nol.
Ionisasi
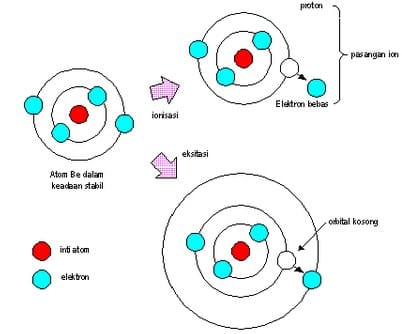
Ionisasi yaitu proses fisik mengubah atom ataupun molekul menjadi ion dengan menambahkan maupun mengurangi partikel bermuatan ibarat elektron.
Proses ionisasi ke muatan positif dan negatif sedikit berbeda. Ion bermuatan positif didapatkan ketika elektron yang terikat pada atom atau molekul menyerap energi yang cukup biar sanggup lepas dari potensial listrik yang mengikatnya. Energi yang diharapkan tersebut disebut potensial ionisasi. Ion bermuatan negatif didapat ketika elektron bebas bertabrakan dengan atom dan terperangkap dalam kulit atom dengan potensial listrik tertentu
Contoh Ionisasi Energi:
- Hidrogen (H) – 13,6
- Klorin (Cl) – 12,97
- Helium (He) – 24,59
- Kalsium (Ca) – 6.11
- Boron (B) – 8,3
- Carbon (C) – 11.26
- Nitrogen (N) – 14.53
- Oksigen (O) – 13,62
- Natrium (Na) – 5.14
- Aluminium (Al) – 5,99
Jari-jari atom
Jari-jari atom yaitu jarak dari inti atom ke orbital elektron terluar yang stabil pada suatu atom dalam keadaan setimbang.
Jenis-jenis jari-jari atom
Ada beberapa jenis jari-jari atom yang digunakan untuk menyatakan jarak dari inti atom ke lintasan stabil terluar dari elektronnya
di antaranya yaitu
- jari-jari kovalen
- jari-jari logam
- jari-jari van der Waals
Jari-jari kovalen
Jari-jari atom yang diukur menggunakan jari-jari kovalen untuk elemen-elemen yang mempunyai jenis ikatan kovalen. Biasannya elemen-elemen ini berupa elemen-elemen non-logam.
Jari-jari logam
Jari-jari atom yang diukur menggunakan jari-jari logam untuk elemen-elemen yang termasuk dalam elemen-elemen logam.
Jari-jari van der Waals
Jari-jari atom yang diukur menggunakan jari-jari van der Waals untuk elemen yang atom-atomnya tidak sanggup saling berikatan. Contoh dari kelompok ini yaitu gas mulia .
Demikianlah klarifikasi materi kali ini, Semoga bermanfaat
Baca Juga :
Sumber https://rumusrumus.com